Enlace Iónico.
* Son sólidos de estructura cristalina en el sistema cúbico.
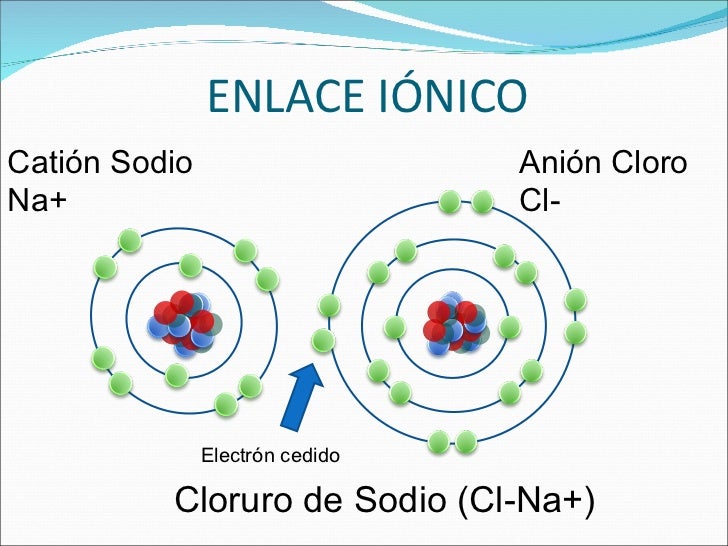
* Este enlace se produce una transferencia de electrones de un metal a un no metal formando iones
* Altos puntos de fusión y ebullición.
* Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
* Son solubles en solventes polares y aun así su solubilidad es muy baja.
* Una vez fundidos o en solución acuosa, sí conducen la electricidad.
* En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla, del extraño circuito, se encenderá . Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello este funciona.
* Este enlace se produce una transferencia de electrones de un metal a un no metal formando iones
* Altos puntos de fusión y ebullición.
* Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII.
* Son solubles en solventes polares y aun así su solubilidad es muy baja.
* Una vez fundidos o en solución acuosa, sí conducen la electricidad.
* En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua, pero si disolvemos sal en abundancia en dicho cubo, la bombilla, del extraño circuito, se encenderá . Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello este funciona.
Ejemplos de enlaces iónicos:
Óxido de magnesio (MgO)
Sulfato de cobre (CuSO4)
Ioduro de potasio (KI)
Hidróxido de zinc (Zn(OH)2)
Cloruro de sodio (NaCl)
Nitrato de plata (AgNO3)
Fluoruro de litio (LiF)
Cloruro de magnesio (MgCl2)
Hidróxido de potasio (KOH)
Nitrato de calcio (Ca(NO3)2)
Fosfato de calcio (Ca3(PO4)2)
Dicromato de potasio (K2Cr2O7)
Fosfato disódico (Na2HPO4)
Sulfuro de hierro (Fe2S3)
Bromuro de potasio (KBr)
Ácido sulfúrico (H2SO4)
Carbonato de calcio (CaCO3)
Hipoclorito de sodio (NaClO)
Sulfato de potasio (K2SO4)
Cloruro de manganeso (MnCl2)
Fuente: http://www.ejemplos.co/20-ejemplos-de-enlace-ionico/#ixzz4PSbUArxgSulfato de cobre (CuSO4)
Ioduro de potasio (KI)
Hidróxido de zinc (Zn(OH)2)
Cloruro de sodio (NaCl)
Nitrato de plata (AgNO3)
Fluoruro de litio (LiF)
Cloruro de magnesio (MgCl2)
Hidróxido de potasio (KOH)
Nitrato de calcio (Ca(NO3)2)
Fosfato de calcio (Ca3(PO4)2)
Dicromato de potasio (K2Cr2O7)
Fosfato disódico (Na2HPO4)
Sulfuro de hierro (Fe2S3)
Bromuro de potasio (KBr)
Ácido sulfúrico (H2SO4)
Carbonato de calcio (CaCO3)
Hipoclorito de sodio (NaClO)
Sulfato de potasio (K2SO4)
Cloruro de manganeso (MnCl2)
Comentario: Nos ayuda a distinguir entre el electropositivo y el electronegativo.
autor: David Estrella... Jared Cruz.
No hay comentarios:
Publicar un comentario